Gliederung dieser Seite
Atommodell
Zur Zeit sind 115 chemische Elemente bekannt. 91 davon kommen natürlich vor, die anderen sind ausschließlich künstlich erzeugt worden.
Alle diese chemischen Elemente bestehen letztlich aus Atomen als kleinsten Bausteinen. Ein Atom ist für uns unvorstellbar klein: etwa 10-10 m. Da man sie also nicht so ohne weiteres beobachten kann, wurden aus der Auswertung und Interpretation von physikalischen Experimenten Modelle entwickelt, wie man sich ein Atom aufgebaut vorstellen könnte. Das bekannteste Modell wurde von den Physikern E. Rutherford und N. Bohr entwickelt. Es beschreibt das Atom bestehend aus einem sehr kleinen Atomkern, in dem fast die gesamte Masse des Atoms vereinigt ist und einer Atomhülle, in der sich die Elektronen um den Kern bewegen.
Der Atomkern
Der Atomkern besteht dabei aus elektrisch neutralen Neutronen und positiv geladenen Protonen, die auch unter dem Begriff Nukleonen (Kernteilchen) zusammengefasst werden. Ein chemisches Element wird nun durch die Anzahl der Protonen in seinem Atomkern eindeutig bestimmt. So hat ein Wasserstoffatom ein Proton in seinem Kern, ein Heliumatom zwei, Kohlenstoff beispielsweise 6 und Blei 82 Protonen.
Da sich elektrische Ladungen gleicher Polarität abstoßen, wären Atomkerne mit mehreren Protonen eigentlich nicht denkbar. Tatsächlich enthalten Kerne, die mehr als ein Proton enthalten immer auch Neutronen. Diese vermitteln eine sehr viel stärkere Bindungskraft, als die elektrische Abstoßung zwischen den Protonen: Die so genannten Kernkräfte. Diese Kräfte sind zwar sehr viel stärker, haben aber andererseits eine sehr viel geringere Reichweite als die elektrischen Kräfte. Neutronen sind also - außer beim Wasserstoff - immer im Atomkern präsent. Bis zum Element Calcium ist die Anzahl der Neutronen und Protonen im Kern üblicherweise gleich groß. Bei Elementen höherer Ordnungszahlen überwiegen die Neutronen, z. T. sogar erheblich. Atome mit unterschiedlichen Neutronenzahlen bei gleicher Protonenzahl bezeichnet man als Isotope eines Elements. Diese unterscheiden sich bezüglich ihrer chemischen Eigenschaften nicht voneinander, wohl aber bezüglich ihrer kernphysikalischen Eigenschaften.
Die Atomhülle
Die Hülle eines Atoms wird durch die Elektronen gebildet, die sich um den Kern bewegen. Dabei ist üblicherweise die Anzahl der Elektronen in der Hülle gleich der der Protonen im Kern. Differieren diese Zahlen, dann ist das Atom nicht mehr elektrisch neutral und man spricht von einem Ion. Die Bewegung der Elektronen um den Kern beschreibt man meist mit Hilfe der Energie, die die Elektronen dabei haben. Diese Beschreibung liegt nahe, weil experimentelle Untersuchungen gezeigt haben, dass man ganz charakteristische Energiemengen benötigt, um einzelne Elektronen vom Atom zu lösen bzw. umgekehrt charakteristische Energiemengen frei werden, wenn ein Atom sich ein fehlendes Elektron einfängt. Diese Energiewerte sind so charakteristisch, dass man an Hand solcher Messungen chemische Elemente eindeutig erkennen kann.
Die Veranschaulichung dieser Situation geschieht im Atommodell dadurch, dass die Elektronen mit der festesten Bindung an den Kern, deren Entfernung also den größten Energieaufwand bedeuten würde, auf kernnahen Bahnen dargestellt werden. Diese Bahnen existieren nicht wirklich. Sie sind lediglich eine grob vereinfachte Hilfsdarstellung der Energieniveaus eines Elektrons.
Solche Darstellungen sind für ein Wasserstoff- ein Helium- und ein Kohlenstoffatom nachstehend abgebildet.
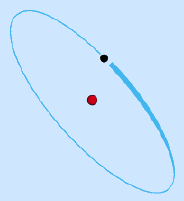 |
Vereinfachtes Modell des Wasserstoffatoms* |
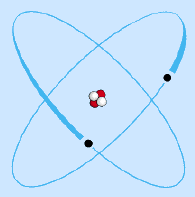 | Vereinfachtes Modell des Heliumatoms* |
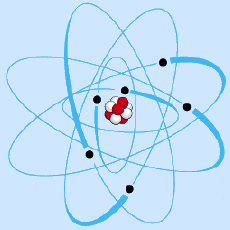 |
Vereinfachtes Modell des Kohlenstoffatoms* |
Die Größenverhältnisse in einem Atom
Bemerkenswert sind die Größenverhältnisse in einem Atom. Der Durchmesser der Hülle beträgt, wie bereits erwähnt etwa 10-10 m. Der Kerndurchmesser beträgt hingegen nur 10-14 m, ist also 10 000 mal kleiner als die Hülle. Da man sich das nur schwer vorstellen kann, soll auch hier ein Beispiel genannt werden: Wenn der Atomdurchmesser 100 m betragen würde, das entspricht etwa der Höhe eines kleineren Fernsehturmes, dann hätte der Kern einen Durchmesser von 1 cm, also etwa die Größe eines Kirschkernes.
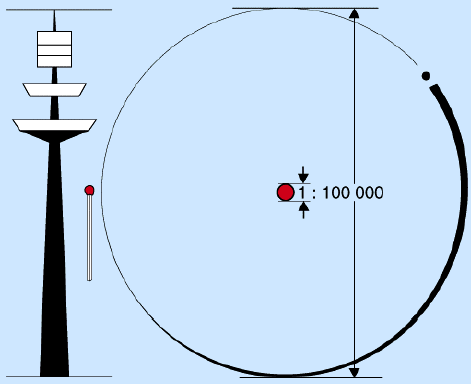 |
Größenverhältnisse in einem Atom* |
Die Massenverhältnisse in einem Atom
Außerordentlich interessant sind auch die Massenverhältnisse. Protonen und Neutronen haben nahezu die gleiche Masse. Die Masse des Elektrons hingegen beträgt nur den 1836ten Teil der Masse eines Protons. Das ist so wenig, dass man den Anteil der Elektronen an der gesamten Masse des Atoms in guter Näherung vernachlässigen kann. Eine Übersicht über einige Eigenschaften der Elektronen, Protonen und Neutronen sind in der folgenden Tabelle dargestellt.
| Elementarteilchen | Masse (Ruhemasse) | Ladung | ||
| in kg | in Elektronen- massen | in Coulomb | in Elementar- ladungen | |
| Elektron | 9,10938·10 -31 | 1 | - 1,6022·10 -19 | -1 |
| Proton | 1,67262·10 -27 | 1836,15 | 1,6022·10 -19 | +1 |
| Neutron | 1,67493·10 -27 | 1838,68 | 0 | 0 |
Die Massen von Protonen und Neutronen, aus denen sich der Atomkern zusammensetzt und die praktisch die Gesamtmasse eines Atoms repräsentieren, liegen in der Größenordnung von 10-27 Kg. Das Rechnen mit solch kleinen Größen ist im Alltag jedoch nicht praktikabel. Deshalb gibt man zur Beschreibung der Masse eines Atomkerns - und damit in Näherung des gesamten Atoms - lediglich an, wie viele Protonen und Neutronen der Kern enthält. Diesen Wert bezeichnet man als die Massenzahl eines Atomkerns.
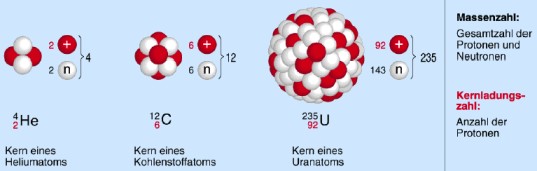 |
Massenzahlen* |
Neben der Masse ist die elektrische Ladung des Kerns eine wichtige Größe. Diese wird bestimmt durch die Anzahl der Protonen im Kern. Die Anzahl der Protonen wird deshalb Kernladungszahl genannt und charakterisiert das chemische Element. Die Kernladungszahl entspricht der Ordnungszahl des jeweiligen Elements im Periodensystem der Elemente. Eine Atomart, die durch Angabe der Neutronenzahl und der Protonenzahl eindeutig charakterisiert ist, bezeichnet man als ein Nuklid.
Konventionen und Schreibweisen
Die Schreibweise dieser Charakterisierung eines Atomkerns erfolgt so, dass die Massenzahl des Kernes oben links und die Kernladungszahl unten links neben dem Symbol des chemischen Elements dargestellt wird. Da für ein chemisches Element die Anzahl der Protonen, die ja der Ordnungszahl des Elements im Periodensystem entspricht, bekannt ist, schreibt man häufig vereinfacht lediglich die Massenzahl des Atoms rechts neben das Formelzeichen des Elements. So sind beispielsweise folgende Schreibweisen gleichbedeutend:
| Kern eines Heliumatoms | Kern eines Kohlenstoffatoms | Kern eines Uranatoms | |||||||||
|
|
|
|||||||||
| He 4 | C 12 | U 235 | |||||||||
| Massenzahl 4 Kernladungszahl 2 |
Massenzahl 12 Kernladungszahl 6 |
Massenzahl 235 Kernladungszahl 92 |
Die Abbildungen stammen aus Kernenergie Basiswissen von Martin Volkmer, Informationskreis Kernenergie, 2003




